Bei der ANCA-assoziierten Vaskulitis kommt es zu einer starken Entzündung der kleineren und mittleren Blutgefäße in der Lunge. Darüber hinaus können auch Haut und Nieren betroffen sein. ANCA steht für “anti-neutrophile cytoplasmatische Antikörper”, das heißt vom Körper gebildete Antikörper, die sich gegen eigene weiße Blutkörperchen richten. Es handelt sich um eine seltene, schwere Autoimmunerkrankung, die aufgrund von Lungenblutungen unbehandelt oft tödlich verläuft.
Zur Therapie werden Medikamente verabreicht, die das Abwehrsystem unterdrücken. Seit kurzem wird auch versucht, mit Inhibitoren die Entzündungskaskade zu blockieren. “Die Herausforderung bei der Suche nach neuen Therapien besteht darin, dass man nur sehr wenig über die Mechanismen weiß, die die Krankheit auslösen”, sagt Prof. Natalio Garbi vom Institut für Molekulare Medizin und Experimentelle Immunologie (IMMEI) des Universitätsklinikums Bonn.
Der Wissenschaftler hat nun zusammen mit Kolleginnen und Kollegen aus Deutschland, den Niederlanden, der Schweiz und Großbritannien mit dem cGAS/STING/IFN-I-Signalweg einen Mechanismus entdeckt, der für die Ausbildung der Krankheit verantwortlich ist. “Wir konnten an unserem Mausmodell zeigen, dass sich die Symptome der Autoimmunerkrankung – wie die Lungenblutungen – verbessern, wenn dieser Signalweg mit Medikamenten blockiert wird”, sagt Erstautorin und Doktorandin Nina Kessler aus dem Team von Natalio Garbi. Für die Studie wurden Proben von einem neuen Mausmodell sowie von 31 Patientinnen und Patienten mit ANCA-Vaskulitis sowie von 57 gesunden Kontrollpersonen untersucht.
Verirrte DNA
Normalerweise befindet sich die Erbsubstanz DNA nur im Kern oder in den Mitochondrien von Zellen. Haben sich aber Krankheitserreger wie Bakterien oder Viren in der Zelle eingenistet, hinterlassen sie eine DNA-Spur im Zytosol, die ein spezieller Sensor mit Namen cGAS erkennt. Dieser Wächter erzeugt ein Molekül namens cGAMP, das wiederum das Molekül STING aktiviert. In der Folge kommt es zur Produktion von Typ-1-Interferon (IFN-I), das zu einer starken Entzündung führt. Dadurch soll die Vermehrung der Erreger unterbunden und stark befallene Zellen sogar in den zellulären Selbstmord getrieben werden.
“Problematisch wird es, wenn diese Mechanismen nicht durch Krankheitserreger, sondern durch unsere zelleigene DNA ausgelöst werden”, erläutert Garbi. Dann führt der cGAS/STING/IFN-I-Signalweg zum Absterben von Zellen. “In unserer Studie zeigen wir, dass aus noch unbekannten Gründen DNA aus dem Zellkern freigesetzt wird und den Signalweg aktiviert. Dies führt zur Zerstörung der Blutgefäße und zu offenen Blutungen”, sagt Garbi, Mitglied im Exzellenzcluster ImmunoSensation2 der Universität Bonn.
Forschende vollziehen Krankheitsentwicklung in Mäusen nach
Die Wissenschaftlerinnen und Wissenschaftler haben die wichtigsten Schritte der Krankheitsentwicklung in Mäusen nachgebildet. Hierfür verabreichten sie den Tieren pathogene Autoantikörper und brachten bakterielle Produkte in deren Lunge, um eine Infektion zu imitieren, wie sie bei einem ANCA-Vaskulitis-Schub vorkommt. Die Mäuse entwickelten daraufhin eine Lungenerkrankung und Blutungen. An verschiedenen Stellen unterbrachen die Forschenden die cGAS/STING/IFN-I-Signalkette, in dem sie bestimmte Gene “stumm” schalteten – etwa für das IFN-I oder für bestimmte Makrophagen des Immunsystems.
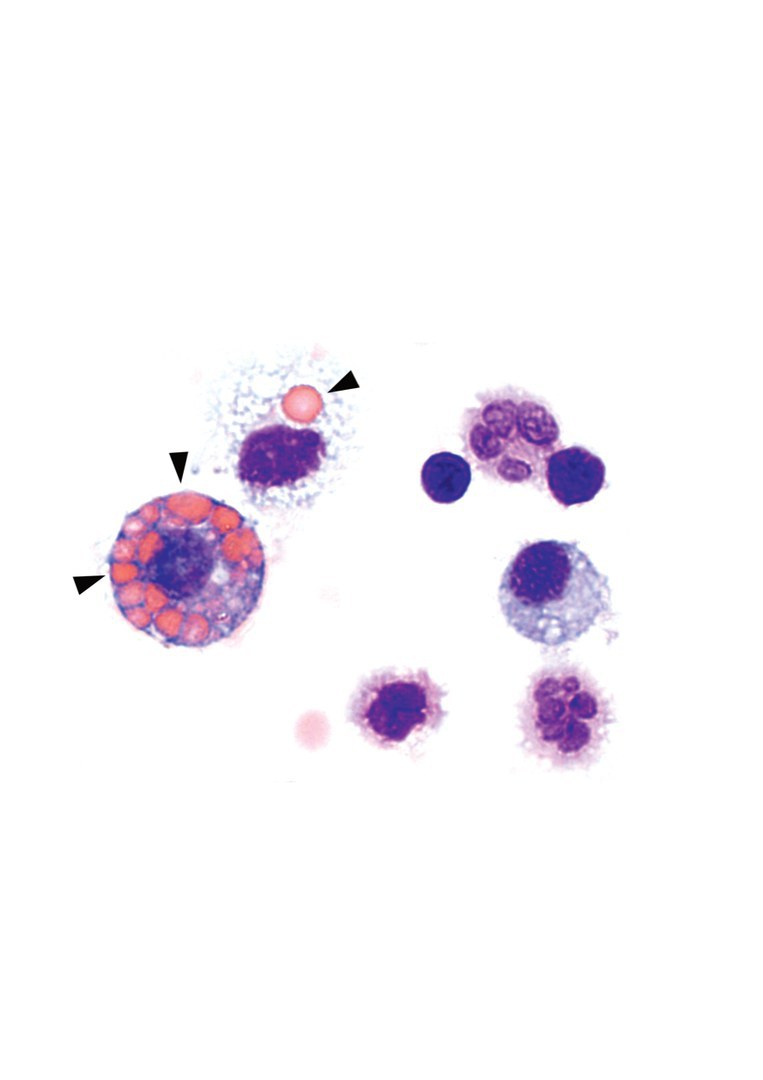
Aus den Ergebnissen an den Mäusen folgern die Forschenden, dass tatsächlich eine Überaktivierung von cGAS/STING durch in der Zelle fehlplatzierte DNA zu der schweren Erkrankung führt. Erhöhte Blutwerte für IFN-I und cGAMP bei den untersuchten Patientinnen und Patienten deuten darauf hin, dass der außer Kontrolle geratene DNA-Wächter in den Zellen für das Fortschreiten der Krankheit verantwortlich ist. “Immunzellen sind Freunde und Feinde der Krankheit”, sagt Dr. Susanne Viehmann aus dem IMMEI-Labor von Prof. Christian Kurts. Makrophagen, die aus dem Blut stammen, produzieren das Entzündungsmolekül IFN-I, dass die Krankheit vorantreibt. Gleichzeitig fressen eine andere Art von Makrophagen in den Lungenbläschen rote Blutkörperchen auf, die aus den Gefäßen austreten, und mindern damit entzündungsfördernde Faktoren.
“Durch das bessere Verständnis der molekularen Prozesse der schweren ANCA-Vaskulitis ist es uns im präklinischen Modell gelungen, potenzielle Ansatzpunkte für Medikamente zu finden, die bereits für andere Krankheiten zugelassen sind”, sagt Garbi. Allerdings sei noch weitere intensive Forschung erforderlich.
Beteiligte Institutionen:
An der Studie waren neben dem Institut für Molekulare Medizin und Experimentelle Immunologie, das Institut für Klinische Chemie und Klinische Pharmakologie, die Medizinische Klinik III, die Klinik für Strahlentherapie und Radioonkologie des Bonner Uniklinikums, die TU Dresden, die University of Cambridge, die Universität Groningen, die Universität Maastricht, die Ludwig Maximilians Universität München, das Universitätsklinikum Aachen, das Helmholtz-Zentrum München, das Max-Planck-Institut für Neurobiologie Martinsried und das Swiss Federal Institute of Technology in Lausanne beteiligt.