Fast 100 Milliarden Nervenzellen verrichten im menschlichen Gehirn ihren Dienst. Jede davon verfügt im Schnitt über 1.000 Kontakte zu anderen Neuronen. An diesen sogenannten Synapsen findet die Informationsweitergabe zwischen den Nervenzellen statt.
Allerdings sind Synapsen weit mehr als eine simple Verdrahtung. Das lässt sich schon an ihrem Aufbau ablesen: Sie bestehen aus einer Art Sendevorrichtung, der Präsynapse, und einer Empfänger-Struktur, der Postsynapse. Dazwischen liegt der synaptische Spalt. Dieser ist zwar sehr schmal. Dennoch verhindert er, dass die elektrischen Impulse einfach weitergeleitet werden können. Stattdessen rufen sich die Neuronen ihre Informationen über den Spalt hinweg gewissermaßen zu.
Dazu wird die Präsynapse durch eingehende Spannungspulse dazu bewegt, bestimmte Botenstoffe auszuschütten. Diese durchqueren den synaptischen Spalt und docken auf der postsynaptischen Seite an bestimmten „Antennen“ an. Dadurch lösen sie in der Empfängerzelle ebenfalls elektrische Pulse aus. „Wieviel Neurotransmitter die Präsynapse freisetzt und wie stark die Postsynapse darauf reagiert, wird jedoch im Gehirn strikt reguliert“, erklärt Prof. Dr. Susanne Schoch McGovern von der Klinik für Neuropathologie am Universitätsklinikum Bonn.
Ausgeklügelte Kontrollmechanismen
So werden beim Lernen bestimmte Synapsen gestärkt: Schon ein schwacher elektrischer Reiz des Sender-Neurons reicht dann aus, um in der Empfängerzelle eine starke Antwort auszulösen. Wenig genutzte Synapsen verkümmern dagegen. Zusätzlich verhindern ausgeklügelte Kontrollmechanismen, dass sich die elektrische Aktivität im Gehirn zu stark ausbreiten kann – oder im Gegenteil zu schnell wieder versiegt. „Wir sprechen auch von synaptischer Homöostase“, erklärt Prof. Dr. Dirk Dietrich von der Klinik für Neurochirurgie am Universitätsklinikum. „Sie sorgt dafür, dass sich die Hirnaktivität stets in einem gesunden Bereich befindet.“
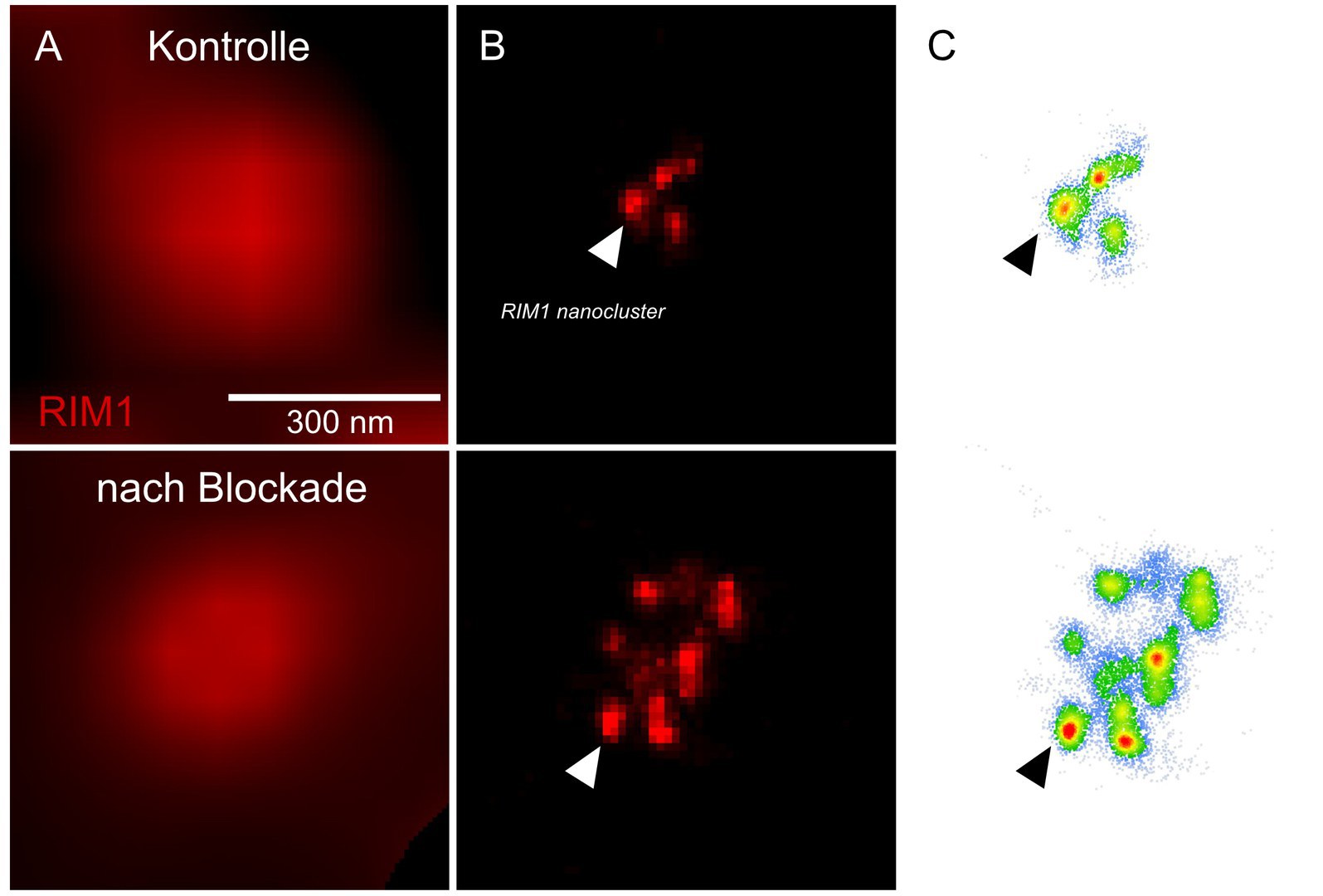
Welche Prozesse dieses Gleichgewicht aufrechterhalten, ist bislang aber erst in Teilen verstanden. Ein Mechanismus, mit dem das Gehirn auf langanhaltende Veränderungen der neuronalen Aktivität reagiert, ist die sogenannte homeostatische Plastizität. „Wir konnten nun zeigen, dass ein Protein namens RIM1 eine Schlüsselrolle in diesem Prozess spielt“, sagt Schoch McGovern. RIM1 kommt gehäuft in der sogenannten „aktiven Zone“ der Präsynapse vor – das ist der Bereich, an dem die Neurotransmitter ausgeschüttet werden.
Wie jedes Protein besteht RIM1 aus einer großen Zahl aneinanderhängender Aminosäuren. Die Forschenden haben nun nachgewiesen, dass manche dieser Aminosäuren durch ein Enzym mit einer chemischen Verbindung verknüpft werden, einer Phosphatgruppe. Je nachdem, welche Aminosäure so modifiziert wird, kann die Präsynapse danach mehr oder auch weniger Botenstoff freisetzen. Die Phosphatgruppen bilden sozusagen das „Gedächtnis“ der Synapsen, mit dem diese das aktuelle Aktivitätsniveau in Erinnerung behalten. „In der Präsynapse stehen transmittergefüllte Bläschen wie die Pfeile eines gespannten Bogens zum Abschuss bereit“, sagt Dietrich. „Sobald ein Spannungspuls einläuft, werden sie blitzschnell freigesetzt. Die Phosphorylierung verändert die Zahl dieser Bläschen.“
Synapse ruft mit lauterer Stimme
Kann die Präsynapse dadurch mehr Bläschen „verschießen“, wird ihr Ruf über den synaptischen Spalt bildlich gesprochen lauter. Nimmt dagegen die Zahl der Bläschen durch Veränderungen im Phosphorylierungsstatus von RIM1 stark ab, ist der Ruf kaum noch hörbar. „Welcher Effekt eintritt, hängt von der phosphorylierten Aminosäure ab“, sagt Dr. Johannes Alexander Müller aus der Arbeitsgruppe von Schoch McGovern. Er teilt sich mit seiner Kollegin Dr. Julia Betzin die Erstautorenschaft der Studie.
Über RIM1 kann das Gehirn die Aktivität einzelner Synapsen also vermutlich sehr genau einstellen. Eine weitere Schlüsselrolle spielt dabei das Enzym SRPK2: Es hängt die Phosphatgruppen an die Aminosäuren von RIM1. Daneben gibt es aber noch weitere Akteure – zum Beispiel Enzyme, die die Phosphatgruppen im Bedarfsfall wieder entfernen. „Wir gehen davon aus, dass ein ganzes Netzwerk von Enzymen existiert, die auf RIM1 einwirken, und dass sich diese Enzyme auch gegenseitig in ihrer Aktivität steuern“, erklärt Dietrich.
Das synaptische Gleichgewicht ist immens wichtig; ist es gestört, können Krankheiten wie die Epilepsie, aber möglicherweise auch Schizophrenie oder Autismus die Folge sein. Interessanterweise ist die Erbinformation für RIM1 bei Menschen mit diesen psychischen Störungen oft verändert. Damit ist das RIM1-Protein bei ihnen eventuell weniger funktionsfähig. „Wir wollen diese Zusammenhänge nun weiter aufklären“, sagt Schoch McGovern, die auch Mitglied im Transdisziplinären Forschungsbereich „Leben und Gesundheit“ ist. „Vielleicht erwachsen aus unseren Ergebnissen langfristig neue Therapie-Optionen für diese Erkrankungen, auch wenn es bis dahin sicher noch ein weiter Weg ist.“
Beteiligte Institutionen und Förderung:
Die Studie wurde durch die Deutsche Forschungsgemeinschaft (DFG), das BONFOR-Programm des Universitätsklinikums Bonn, das Australische National Health and Medical Research Council (NHMRC) sowie die Krebsforschungs-Stiftung und das Krebs-Institut New South Wales gefördert. An der Arbeit waren neben der Universität und dem Universitätsklinikum Bonn die Universität Sydney sowie die australische Firma i-Synapse beteiligt.
Publikation: Johannes Alexander Müller, Julia Betzin, Jorge Santos-Tejedor, Annika Mayer, Ana-Maria Oprişoreanu, Kasper Engholm-Keller, Isabelle Paulußen, Polina Gulakova, Terrence Daniel McGovern, Lena Johanna Gschossman, Eva Schönhense, Jesse R. Wark, Alf Lamprecht, Albert J. Becker, Ashley J. Waardenberg, Mark E. Graham, Dirk Dietrich, Susanne Schoch: A presynaptic phosphosignaling hub for lasting homeostatic plasticity; Cell Reports; DOI: https://doi.org/10.1016/j.celrep.2022.110696
KONTAKT:
Prof. Dr. Susanne Schoch McGovern
Klinik für Epileptologie und Institut für Neuropathologie am Universitätsklinikum Bonn
Tel.: +49 228 28719109
E-Mail: susanne.schoch@uni-bonn.de
Prof. Dr. Dirk Dietrich
Klinik für Neurochirurgie
Universitätsklinikum Bonn
Tel.: +49 228 287 19224
E-Mail: dirk.dietrich@uni-bonn.de